春期集中講座を実施します。 得意科目を伸ばし苦手科目の克服を目指して、新入生は中学入学に備えて、是非参加してください。期間・時間割等は特別講習のページを見てください。
カテゴリー別アーカイブ: ニュース&インフォメーション
2021年度 教科書が変わります
中学校学習指導要領改訂で新しい教科書での授業が始まります。これまでの教科書改訂は1年生からのみ開始でしたが今回の改訂では全学年5教科すべてが全面実施となります。
今回の基本的な考え方は すべての教科等を ①知識及び技能,②思考力・判断力・表現力等,③学びに向かう力・人間性等 の3つの柱で主体的・対話的で深い学びの実施に向けた授業改善です。また、新しく学ぶ内容は ・言語能力の育成,・理数教育の充実,・道徳教育,・伝統や文化に関する教育 が挙げられています。
変化が大きいのは ①英語 ②理科 ③数学 の順となっています。 特に英語は小学校中学年から「外国語教育」が導入され、英語教育全体が大きく変化するなど、社会の変化に対応した学びが取り入れられています。なかでも中学1年では小学校で教科化されたことから内容が大きく変化し、中学3年では半世紀ほど前に遡り、高校の内容が再び導入されています。
光塾でも今まで以上に基本の徹底に力を入れていきたいと思います。そして、①教科書,ノート,筆記用具等持ち物を忘れない。②宿題をきちんと仕上げてくる。③予習・復習などの自宅学習に時間をとる。④授業に遅れない。など 当たり前のことを当たり前に出来る子供たちであって欲しいと願っています。
主な変更点
英語
単語数(旧)小学校 0 中学校 1200 合計 1200
(新)小学校 600~700 中学校 1600~1800 合計 2200~2500 約2倍
文法 高校で学習している ・仮定法 ・現在完了進行形 ・原形不定詞 ・直接目的語に節を取る第4文型 が中学に移行
履修順 小学校での英語の教科化および高校内容の移行で学習内容の順番が大きく変わる。
数学
1年 追加 素数(小5から) 素因数分解(中3から)多数の観察や多数回の試行によって得られる確率(中2から) 累積度数(新規)
削除 誤差や近似値・a×10nでの表現(中3へ) 平均値・中央値・最頻値・階級(小6へ)
2年 追加 反例(新規) 四分位範囲・箱ひげ図(新規)
削除 多数の観察や多数回の試行によって得られる確率(中1へ)
3年 追加 誤差や近似値・a×10nでの表現(中1から)
削除 素因数分解(中1へ)
理科
1年 物理分野の「圧力」が2年地学に移動、「水圧」は3年物理に移動
2年 化学分野で用語に「元素」が追加され、用語の「化合」が削除 地学分野で「圧力」が1年物理から移動
3年 物理分野で「水圧」が1年物理から移動 「力のつり合い」が1年物理に移動
化学分野で「ダニエル電池」,「同位体」が追加 用語の「イオン式」が削除
生物分野で用語の「優性」「劣性」が「顕性」「潜性」に変更
日時計その2
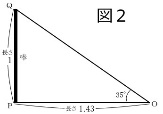
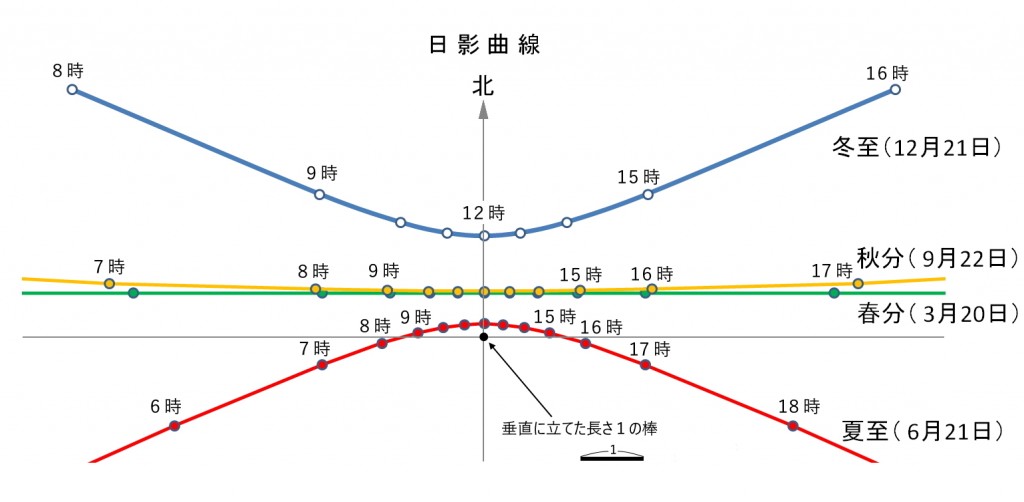
図1は前回に説明した日影曲線ですが、図中の4つの季節の日影曲線上の同じ時刻の点をつなぐと一本の直線になり、それらの直線がなんと一点(点Oと名付ける)で交わります。この点Oは日影曲線を描くために立てた棒の位置(点Pと名付ける)から棒の長さの1.43倍の距離にあります。棒の先端をQ点として、棒と点Oでできる直角三角形POQを描くと図2のようになり、頂点Oの角度は35°で日影曲線を描くとき使った豊中の緯度35°と一致しています。と言うことは直線OQはQの方に延長していくと北極星に当たるということで、また直線OQは地軸に平行ということです。
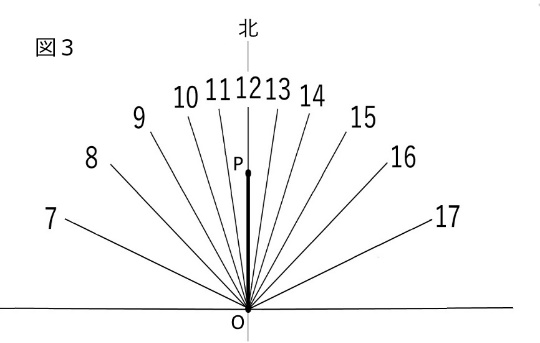
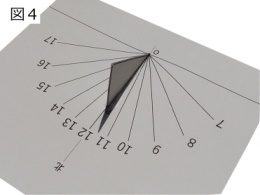
では、いよいよ日時計を作りましょう。下の図3は上の日影曲線にある同時刻の点をつないだ直線群だけにしたもので、日時計の文字盤になります。この文字盤に図2の直角三角形の板を点Oが一致するように文字盤の南北の線上に立てれば完成(図4)です。
ここでは豊中(北緯35°付近)で使うことを前提にしていますので豊中から大きく北や南に離れると不正確になります。
また、文字盤に取り付ける三角形については、時刻を読み取るのは直線OQの影を利用するので、極端に言えば三角形の板ではなく水平面と35°をなすまっすぐで適当な長さの棒で良いのです。このことを利用して自分なりの日時計を作ることもできます。
夏期講習実施中
7月から夏期講習を実施しています。(特別講習参照)
今年はコロナウイルス流行のため変則的になっています。
日時計 その1
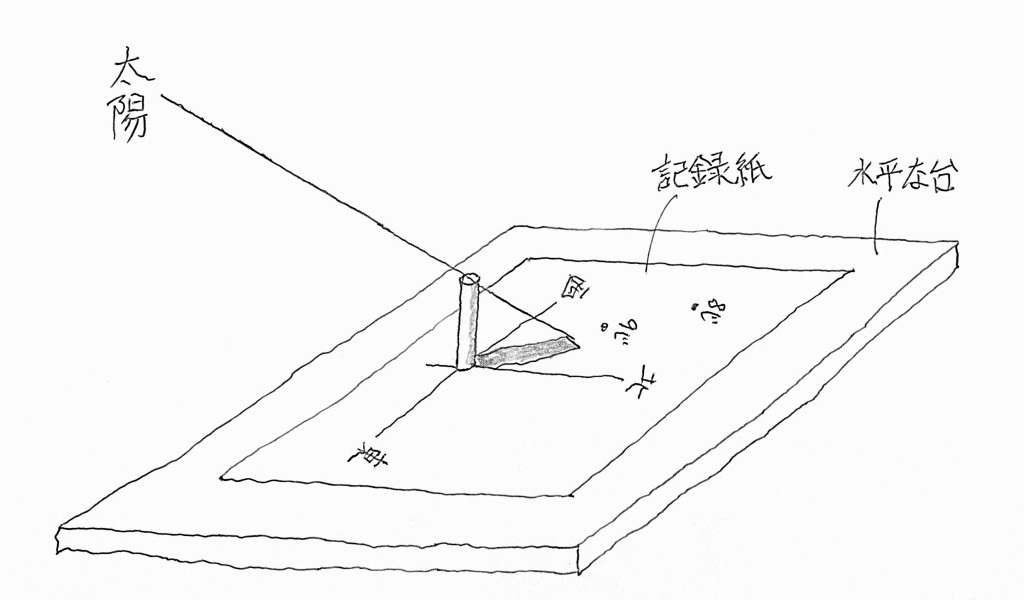
私たちが日常使っている「時間」は太陽の動きから決められているので、地面に垂直に立てられた棒の影の位置から今の時刻を知ることができます。そこで、板に垂直に棒を立てその板を日当たりのよいところに水平に置いて、太陽による棒の先端の影を朝から夕方にかけて板に記録していくと曲線ができて、この曲線を「日影曲線」といいます。この曲線上の7時,8時・・・・の正時刻の点を記録しておくと日時計ができます。
太陽の1日の動きは中学3年理科の地学分野で勉強します。それによると太陽の動きは年間を通じて一定ではなく、春(春分の日)には真東から出て真西に沈みます。その日から少しずつ北に移動して夏至の日には東から約29度北に寄ったところから出て、真西から約29度北に寄ったところに沈みます。夏至を過ぎると南に移動を始め秋(秋分の日)には真東から出て真西に沈みます。秋分の日のあとさらに南に移動して冬至の日には東から約29度南に寄ったところから出て、沈む位置は真西から約29度南に寄ったところになります。冬至を過ぎると北に移動を始め春(春分の日)に戻ります。1年の周期で変化するわけです。この変化は地球の自転軸が公転面に垂直な方向から23.4°傾いていることによって生じており、日本(地球の中緯度地域)に四季をもたらしています。さらに観測する緯度によっても太陽の位置(高度)が変わるので「日影曲線」は日時と場所によって変わります。
ここで、場所は豊中(北緯35°)として春分・夏至・秋分・冬至それぞれの日の日影曲線を紹介しましょう。ただし、この曲線は実際に測定して得たものではなく、私がエクセルを利用して計算によってシミュレートしたものです。
次回はこの曲線を利用して日時計を作製したいと思います。
お知らせ
※ 個人懇談の中止
毎年この時期には個人懇談を実施していましたが、今年は新型コロナウイルスの感染防止のため個人懇談を中止いたします。子供たちのことにつき何かございましたら、電話あるいはご来室いただきますようお願い致します。
※ お盆休み
次の期間 8月12日(水)~ 8月15日(土) お盆休みとさせていただきます。
休み明けは 8月17日(月)からとなります。
新型コロナウイルス
昨年の暮れに中国で始まった新型コロナウイルスによる肺炎の感染が、瞬く間に世界中に広がり大変な状況になっています。緊急事態宣言による社会活動の自粛で感染拡大がある程度は抑えられました。光塾も自粛要請に協力して1ヶ月半の休業をしました。しかし、ウイルスがなくなったわけではなく再び感染拡大が起こる可能性は残されたままで、ワクチンなどの薬が開発されるまでは様々な予防策をとりながらの生活が必要です。光塾では感染を防ぐ対策として講師はもちろん生徒の皆さんにも必ずマスクを着用、そして生徒の入れ替えごとに机と椅子の消毒、換気をして、床のモップ掛けや設備の消毒などを適宜実施しています。生徒たちや保護者の方々の不安を少しでも取り除くことができればうれしいです。
ここで少しウイルスについて
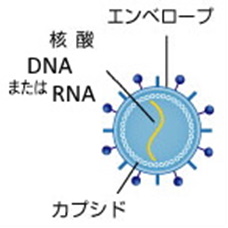
ウイルスは遺伝情報が並んでいるDNAまたはRNAとそれを包んでいるタンパク質の殻(カプシド)で出来たもので、ある種のウイルスはこれらをさらに糖タンパクの膜(エンベロープ)で包んでいるもの(コロナウイルスはこの仲間)もありますが、いずれにしてもとても簡単な構造です。そのため光学顕微鏡では見えず、電子顕微鏡でないとみることはできないほど小さなものです。そして自分で仲間を増やす(子孫を残す)能力はありません。学校では、生物とは基本単位である細胞から出来ており、自分で子孫を残して仲間を増やすものと言う風に教えています。この定義からすると細胞でもなく自分で子孫も残せないウイルスは生物ではないことになります。そのため生物体の細胞に入りこんでその細胞を言わば乗っ取って自分のDNAやRNAを作らせ仲間を増やします。このようにウイルスは生物と物質の境界上にあるものということになります。
新型コロナウイルスに対するワクチンなどの薬が開発されて、1日も早く通常生活が戻ることを祈っています。
緊急事態宣言中の休講について
7日に大阪府を含む7都府県に緊急事態宣言が発令されました。それに伴い当塾は次の様に対応しています。
以前より感染拡大を防ぐために3密を避ける対策として換気・生徒間の間隔確保・マスクの着用さらに消毒などを実施しています。しかし緊急事態宣言を受けて、国および府の施策に協力すべく大変残念なことではありますが11日土曜日から下記の通り休講を実施しています。
・休講期間 2020年4月11日(土) ~ 5月6日(水)
・休講中の課題など 各担当者から指示。
・休講中の授業時間の振替 休業明けに指定する時間内で振替授業を実施。
一日も早く事態が収束し安心して一緒に勉強できる日が来ることを願っています。
4月からの祝日の扱いについて
「4月からの祝日の扱いについて」
今、新型コロナウイルスの流行は日常の生活に大きな影響を与えております。一日も早く通常の生活に戻れるよう願っております。
さて、当塾は2013年4月 地域に根ざす教室・子供たちにわかり易い授業を目標にスタートし、その間 祝祭日は教室を閉めることなく授業をしてまいりましたが、4月から祝祭日は休みとさせていただきますのでご理解のほどお願い致します。(年間48回の授業は確保致します)
この7年間で子供たちを取り巻く環境や学習内容も大きく変化しました。たくさんの課題を抱えながら今後も従来の変わらぬ理念を大切にしつつ変化に対応できるよう、子供たちと共に考え指導してまいります。
<教室と指導内容について>
① 対象・・・ 小学生 中学生 高校生 1クラス6名までの少人数制
○小学生(5・6年) 算数,英語,理科 週1回50分
○小学生プログラミング 月1回60分
○高校生 物理 週1回60分
※特別講習として春・夏・冬期講習
※3年生は9月から演習授業があります
○忘れ物をしないこと(教科書・ノート・筆記用具など)
○宿題をしてくること(授業を理解するためには家庭学習も必須です)
④ 講師・・・教科毎の専任講師
公立中学が休校中の光塾の授業について
コロナウイルスの感染防止対策の一環で豊中市立の中学校は5月6日まで休校処置になっていますが、当面 当塾は防止対策をし状況を見ながら授業を続ける予定です。
防止対策としては
①換気を頻繁に行う、②生徒間の間隔を十分にとる 座席数6の教室で生徒数1~3人で実施中、③机・椅子等の消毒、④講師のマスク着用 を実行しています。
今後は国や府のコロナウイルスに関する各種の発表 大阪府特に豊中市での感染者の発生数の増加率 を見ながら休講を含めた対応を検討します。
また、保護者の方々へは次のことをお願いしています。
お子様の外出を極力避けたいのでしばらく塾を休みたいとお考えの方はご連絡下さい。
勉強も気になるので教室に行かせるとお考えの方は ①教室内ではなるべくマスクを着用して頂きたいのでマスクの準備、②37.4度以上の熱がある場合は欠席の連絡。